- Der erste Patient in Deutschland wurde im Rahmen der Immatics‘ ACTengine® IMA202-101 Studie behandelt
- Die deutsche Zulassungsbehörde, das Paul-Ehrlich-Institut (PEI), hat den Antrag (CTA, Clinical Trial Application) für eine weitere klinische ACTengine®-Studie in Deutschland genehmigt. Die Studie wird Immatics‘ Produktkandidaten IMA203 untersuchen
- Drei klinische Studienzentren haben in Deutschland mit der Patienten-Rekrutierung für Immatics‘ ACTengine®-IMA200-Studienprogramme begonnen
Immatics N.V. (NASDAQ: IMTX, „Immatics“), ein Unternehmen, das sich auf die Entwicklung und Herstellung von T-Zell-Immuntherapien für die Behandlung von Krebs fokussiert, gab heute die Behandlung des ersten Patienten im Rahmen der IMA202-101 Studie in Europa bekannt. Zuvor hatte das Paul-Ehrlich-Institut (PEI), die Zulassungsbehörde für Zell- und Gentherapien in Deutschland, seine Genehmigung für die Clinical Trial Application (CTA) zur Durchführung der IMA202-101 Studie erteilt. Das PEI hat außerdem eine weitere klinische Phase-1-Studie von Immatics in Deutschland genehmigt, die die Sicherheit, Verträglichkeit und initiale Wirksamkeit von IMA203 evaluieren soll.
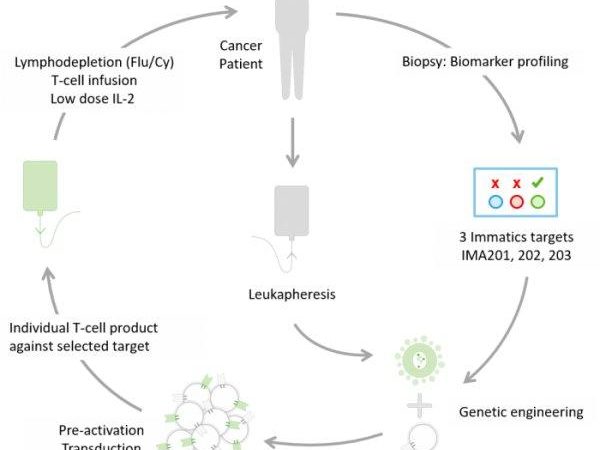
In den klinischen IMA200-Studienprogrammen werden bis zu drei neuartige Krebs-Immuntherapien evaluiert, einschließlich IMA202 (NCT03441100) und IMA203 (NCT03686124). IMA202 und IMA203 wurden entwickelt, um spezifische Peptide zu adressieren, die entweder dem „MAGEA1“ (melanoma-associated antigen 1)-Antigen oder dem „PRAME“ (preferentially expressed antigen in melanoma)-Antigen entstammen. Beide Produktkandidaten basieren auf Immatics‘ firmeneigenem ACTengine®-Ansatz. Hierbei werden die T-Zellen des Patienten gentechnisch modifiziert, sodass sie einen zusätzlichen, exogenen T-Zell-Rezeptor (TCR) exprimieren, der sich gegen hochspezifische Krebs-Zielstrukturen richtet. Ziel ist es, die patienteneigenen T-Zellen mittels dieser krebsspezifischen TCRs selektiv gegen den Tumor zu aktivieren, um ihn so zu bekämpfen. Die Studien werden die Sicherheit und Verträglichkeit von Immatics‘ adoptiven Zelltherapien (ACTs) in Patienten untersuchen, die solide Tumore mit den entsprechenden Krebs-Zielstrukturen aufweisen, sowie initiale Anzeichen einer Anti-Tumor-Aktivität evaluieren. Weiterhin werden die Studien auch die Persistenz der verabreichten, modifizierten T-Zellen im Blut des Patienten überprüfen, da dies ein wichtiges Kriterium für eine mögliche Anti-Tumor-Antwort ist. Ziel hierbei ist es, innovative personalisierte Immuntherapien zu entwickeln, die den Tumor eines Patienten selektiv und effektiv bekämpfen.
Zu den neuen klinischen Studienzentren in Deutschland gehören das Universitätsklinikum Carl Gustav Carus in Dresden, das Universitätsklinikum Bonn und das Universitätsklinikum Würzburg. Zuvor wurden bereits Patienten am The University of Texas MD Anderson Cancer Center in Houston, Texas, und vor Kurzem auch am Columbia University Irving Medical Center in New York sowie dem UPMC Hillman Cancer Center in Pittsburg, Pennsylvania, in die IMA200-Studienserie aufgenommen.
Cedrik Britten, MD, Chief Medical Officer von Immatics, kommentierte: „Im Rahmen unserer Strategie, unser Netzwerk an Studienzentren international zu erweitern, eröffnen wir aktuell neue Studienstandorte in den USA und Europa. Wir freuen uns sehr über die rasche Zulassungsgenehmigung des PEI und die Behandlung des ersten Patienten in Deutschland. Hierdurch können wir unsere klinischen Entwicklungsaktivitäten global ausweiten und erhalten eine größere operative Flexibilität, welche im Licht der globalen COVID-19 Pandemie noch wichtiger geworden ist. Wir freuen uns auf die weitere Zusammenarbeit mit führenden Klinikern, um das Potenzial von T-Zelltherapien für Krebspatienten auf beiden Seiten des Atlantiks verfügbar zu machen.“
Dr. Martin Wermke, leitender Prüfarzt und Leiter der Early Clinical Trial Unit des Nationalen Centrums für Tumorerkrankungen (NCT/ UCC) am Universitätsklinikum Carl Gustav Carus in Dresden sagte: „Da ich von Anfang an in dieses klinische Forschungsprojekt involviert war, freue ich mich sehr, bei der nächsten Entwicklungsphase dieser spannenden Immuntherapien dabei zu sein. Ich bin überzeugt, dass Immatics‘ innovative T-Zelltherapien das Potential haben, die Zukunft der Therapiemöglichkeiten für solide Tumore und Blutkrebserkrankungen zu verändern.“
Weitere Informationen zu den klinische Studien finden Sie auf www.immatics.com/… und www.clinicaltrials.gov
Über Immatics‘ adoptive Zelltherapien
Adoptive Zelltherapien (ACTs) sind ein therapeutischer Ansatz, der natürliche oder modifizierte T-Zellen nutzt, um Tumore zu bekämpfen. Immatics hat drei innovative, firmeneigene Ansätze entworfen, um adaptive Zelltherapien zu entwickeln: ACTengine®, ACTallo® und ACTolog®.
Über ACTengine®
Immatics’s klinisches ACTengine®-Programm ist ein personalisierter Ansatz für Patienten mit fortgeschrittenen soliden Tumoren. Hierbei werden die T-Zellen eines Patienten gentechnisch verändert, damit diese einen neuartigen firmeneigenen T-Zell-Rezeptor (TCR) exprimieren, der gegen eine bestimmte Krebs-Zielstruktur gerichtet ist. Die Zielstrukturen werden durch Immatics’ firmeneigene XPRESIDENT®-Plattform identifiziert.
Über die klinischen Studien mit ACTengine®-Kandidaten (IMA201, IMA202 and IMA203)
- Das primäre Ziel dieser Studien ist es, die Sicherheit und Verträglichkeit des ACTengine®-Ansatzes in Patienten zu evaluieren, deren solide Tumore die jeweilige Zielstruktur aufweisen.
- Ein weiteres Ziel ist die Evaluierung der Persistenz von T-Zellen in vivo sowie die Analyse der Anti-Tumor-Wirkung.
- Patienten können potenziell an Studien mit ACTengine®-Zelltherapien teilnehmen, wenn sie Tumore mit den entsprechenden Krebs-Zielstrukturen aufweisen. Dies wird durch eine Biomarker-Analyse festgestellt (IMADetectTM).
- Jeder TCR, der in diesen Studien eingesetzt wird, wurde aus den vielen verschiedenen TCRs des menschlichen T-Zell-Repertoires durch Immatics‘ XCEPTORTM ausgewählt. Oberstes Kriterium hierbei ist die bestmögliche Spezifität des TCR.
- In Kollaboration mit dem University of Texas Health Science Center (UTHealth) in Houston, Texas werden die ACTengine®-T-Zell-Produkte im Evelyn H. Griffin Stem Cell Therapeutics Research Laboratory hergestellt.
- Immatics hat einen firmeneigenen Prozess für die optimierte Herstellung von T-Zell-Produkten mit kurzen Produktionszeiten entwickelt. Die TCR-transduzierten T-Zellen werden außerhalb des Körpers aktiviert und vermehrt, bevor sie dem Patienten mittels Infusion verabreicht werden.
Zukunftsgerichtete Aussagen
Bestimmte Aussagen in der Pressemitteilung, können als in die Zukunft gerichtete Aussagen angesehen werden. In die Zukunft gerichtete Aussagen, beziehen sich im Allgemeinen auf zukünftige Ereignisse oder auf die zukünftige finanzielle oder operative Leistung von Immatics. So sind beispielsweise Aussagen über den Zeitplan von Produktkandidaten sowie Immatics‘ Fokus auf Partnerschaften, um seine Strategie voranzubringen, zukunftsgerichtete Aussagen. In manchen Fällen können die zukunftsgerichteten Aussagen durch Verwendung von Begriffen wie „kann“, „sollte“, „erwartet“, „beabsichtigt“, „wird“, „schätzt“, „voraussehen“, „glaubt“, „prognostiziert“, „potenziell“, oder „fortsetzen“ oder die negative Form dieser Begriffe oder einer anderen vergleichbaren Terminologie identifiziert werden. Diese zukunftsgerichteten Aussagen unterliegen Risiken, Ungewissheiten und anderen Faktoren, die dazu führen könnten, dass die tatsächlichen Ergebnisse wesentlich und nachteilig von den Ergebnissen abweichen, die in diesen zukunftsgerichteten Aussagen ausdrücklich oder implizit zum Ausdruck gebracht werden. Diese zukunftsgerichteten Aussagen basieren auf Schätzungen und Annahmen, die zwar von Immatics und seinem Management als sinnvoll erachtet werden, aber grundsätzlich ungewiss sind. Von Zeit zu Zeit können neue Risiken und Ungewissheiten auftauchen, und es ist nicht möglich, alle Risiken und Ungewissheiten vorherzusagen. Zu den Faktoren, die dazu führen können, dass die tatsächlichen Ergebnisse wesentlich von den aktuellen Erwartungen abweichen, gehören unter anderem, aber nicht ausschließlich: verschiedene Faktoren, die sich der Kontrolle des Managements entziehen, einschließlich allgemeiner wirtschaftlicher Bedingungen; sowie andere Risiken, Ungewissheiten und Faktoren, die in den bei der Securities and Exchange Commission (SEC) eingereichten Unterlagen aufgeführt sind. Nichts in dieser Präsentation sollte als eine Zusicherung irgendeiner Person angesehen werden, dass die hierin dargelegten zukunftsgerichteten Aussagen erreicht werden oder dass eines der beabsichtigten Ergebnisse dieser zukunftsgerichteten Aussagen erreicht wird. Der Leser sollte kein unangemessenes Vertrauen in zukunftsgerichtete Aussagen setzen, die nur zu dem Zeitpunkt gelten, zu dem sie veröffentlicht wurden. Immatics übernimmt keine Verpflichtung, diese zukunftsgerichteten Aussagen zu aktualisieren.
Immatics kombiniert die Identifizierung hochspezifischer Zielstrukturen für Krebsimmuntherapien mit der Entwicklung von geeigneten T-Zell-Rezeptoren (TCRs), um eine starke und spezifische T-Zell-Antwort gegen Tumor-Zielstrukturen hervorzurufen. Diese fundamentale Expertise bildet die Basis für unsere Pipeline adoptiver Zelltherapien und bispezifischer TCR-Moleküle sowie für unsere Partnerschaften mit weltweit führenden Pharmaunternehmen. Unsere Mission ist es, das Potential von T-Zelltherapien für Patienten voll auszuschöpfen und neue Wege im Kampf gegen Krebs zu gehen.
Immatics‘ Pipeline beinhaltet T-Zelltherapien die auf Immatics‘ proprietären ACTolog®-, ACTengine®- und ACTallo®-Ansätzen basieren, welche in Kollaboration von Immatics US mit dem MD Anderson Cancer Center der Universität in Texas entwickelt wurden und durch das Cancer Prevention and Research Institute of Texas (CPRIT) kofinanziert wurden. Die ACT-T-Zell-Produkte werden im Evelyn H. Griffin Stem Cell Therapeutics Research Laboratory in Kollaboration mit der UTHealth in Houston, Texas, produziert.
Weitere Informationen zu Immatics, sowie alle Neuigkeiten finden Sie unter www.immatics.com.
Oder folgen Sie uns auf Twitter und LinkedIn.
immatics biotechnologies GmbH
Paul-Ehrlich-Str. 15
72076 Tübingen
Telefon: +49 (7071) 5397-0
Telefax: +49 (7071) 5397-900
http://www.immatics.com
Head of Strategy
Telefon: +1 (281) 810-7545
E-Mail: InvestorRelations@immatics.com
Corporate Communications
Telefon: +49 (89) 540415-606
E-Mail: anja.heuer@immatics.com
![]()